Ciepły dzień późną wiosną, wydawać się może niezbyt właściwą porą dla morderczej i bezlitosnej walki o władzę. Dla pszczół jest to jednak czas wielkiej Gry o Tron, w której zwyciężczyni może być tylko jedna. U podstaw uporządkowanego i słodkiego jak miód królestwa pszczół leży stare jak świat pożądanie władzy oraz możliwości nieograniczonej reprodukcji.
Wśród pszczół, prawo do walki o tron jest jednak ściśle określone, już na długo przed przyjściem na świat nowej pretendentki. Każda pszczoła przechodzi ten sam cykl przeobrażeń: od jaja, przez larwę, poczwarkę aż do w pełni wykształconej postaci dorosłej. Z większości zapłodnionych jaj powstają bezpłodne, za to zdolne do ciężkiej pracy robotnice. Z niezapłodnionych jaj wyrastają mające całkowitą alergię na pracę samce, trutnie. Jednak wyłącznie z kilku zapłodnionych jaj wykształcają się samice zdolne do reprodukcji tzw. matki. W naszej historii istotne jest to, że chociaż DNA robotnic i matek jest takie samo, to fizycznie oraz pod względem zachowań, różnią się one całkowicie. Odmienność ta dotyczy nie tylko wyglądu, ale również fizjologii oraz funkcji pełnionej w pszczelej społeczności. Zanim wyjaśnimy tą zagadkę, przyjrzyjmy się pierwszemu dniu życia przyszłej królowej matki. Od razu po opuszczeniu swojej komórki w ulu, pszczela pretendenta do tytułu królowej, zaczyna obchód gniazda w poszukiwaniu rywalek. Znajduje i zabija wszystkie potencjalne matki, które jeszcze nie zdążyły w pełni przekształcić się w postać dorosłą. Gdy jednak spotkają się dwie dorosłe matki dochodzi do walki na śmierć i życie. Z tego starcia tylko jedna wychodzi zwycięska, pozostawiając za sobą przebite żądałem ciało rywalki. W porównaniu pszczelą królową Lady Makbet może wydawać się niewinną dziewczynką ze złotymi loczkami. Na zakończenie imprezy koronacyjnej królowa odbywa grupowy seks z trutniami, nazywany elegancko lotem godowym. Trutnie są przykładem tej części samczej społeczności, która większą część życia spędza na kanapie, pijąc piwo z zasiłku, z krótką przerwą na seks bez zabezpieczeń. Nie pracują, korzystają z darmowego bufetu w ulu, a ich jedynym życiowym zadaniem jest zapłodnienie królowej podczas lotu godowego. Seks z królową ma jednak swoją cenę. Gdy podchmielony nektarem truteń skończy to co miał do zrobienia, spotyka go bolesna niespodzianka. Kiedy po stosunku próbuje odłączyć się od królowej odrywa sobie odwłok. Następnie z wyrazem bezgranicznego zdziwienia malującego się na aparacie gryząco-liżącym, ginie po spełnieniu ewolucyjnego obowiązku. Dzieciobójstwo, siostrobójstwo i kastracja ze skutkiem śmiertelny. Makbet, Hamlet i Ryszard III mogą jedynie zgrzytać zębami z zazdrości. William Shakespeare przegapił idealny temat na swój największy dramat historyczny.

Wróćmy jednak do pytania co sprawia, że nasza krwiożercza królowa matka, pomimo posiadania tego samego zestawu genów, tak bardzo różni się od normalnych, pracowitych pszczół robotnic. Dzięki badaniom, którym z poświęceniem poddawały się liczne generacje pszczół, wiemy dziś, że królewski status oraz morderczy charakter nie jest zapisany w genach, ale poza nimi. Królowa jest królową dzięki procesom opisywanym przez obszerną dziedziną wiedzy nazywaną epigenetyką. Określenie epigenetyka stworzono z połączenia słowa genetyka oraz greckiego przedrostka epi oznaczającego “poza czymś”. Epigenetyka to dziedzina obejmująca wszystko to co, chociaż nie jest zapisane bezpośrednio w sekwencji DNA (jest “poza” genami), może trwale zmieniać aktywność samych genów. Dzięki mechanizmom epigenetycznym z tego samego zestawu genów, możemy uzyskać zupełnie inny rezultat końcowy taki jak np.: pszczela królowa lub robotnica, komórka mózgu oraz komórka serca. Z regulacją epigenetyczną jest jak z grą na flecie lub kobzie. Ten sam instrument, w zależności od sposobu ułożenia palców na otworach, wydaje zupełnie inne tony. Muzykant dbający o dobrą zabawę nie gra ciągle tego samego dźwięku. Tak samo procesy epigenetyczne starają się o to by w przyrodzie nie wiało nudą. Podobnie jak w przypadku tworzenia muzyki z różnych dźwięków, dzięki regulacji epigenetycznej geny mogą tworzyć różnorodne komórki naszego organizmu. Wszyscy rozpoczęliśmy swoją podróż przez życie od jednej, zapłodnionej komórki jajowej. W wyniku dalszych podziałów powstaliśmy my. Chociaż ogromna większość komórek naszego ciała posiada takie same geny, to jednak nie jesteśmy jedynie wielką galaretowatą kulą zbudowaną z identycznych komórek. Nasz całkiem złożony organizm tworzy ponad 200 rodzajów różnych komórek, współpracujących ze sobą całkiem zgodnie przez większość życia. Epigenetyczna regulacja ustalająca aktywność poszczególnych genów w różnych komórkach, zachodzi już na bardzo wczesnym etapie rozwoju. Jest to proces przewidywalny i zdeterminowany. Jednak pewne silne fizyczne oraz chemiczne bodźce mogą właśnie wtedy drastycznie wpływać na los przyszłego organizmu. Jednym z przykładów epigenetycznej regulacji zachodzącej we wczesnym okresie życia jest przekształcanie się larw pszczół w królowe lub w ciężko pracujące robotnice. Wszystkie larwy pszczół karmione są przez pierwsze 3 dni życia mleczkiem pszczelim, będącym specjalną wydzieliną ślinianek pszczół robotnic. Jednak larwy, które mają zostać królowymi pozostają na tej diecie cały czas, natomiast larwy, których przeznaczeniem jest stanie się robotnicami, po 3 dniach karmione są już tylko standardową mieszanką: pyłku, nektaru i miodu. Pozornie mało istotna różnica w diecie ma decydujący wpływ na uruchomienie epigenetycznego mechanizmu regulacyjnego. Zmiana ta sprawia, że budowa pszczół robotnic i królowych jest zupełnie inna. U królowych następuje wykształcenie sprawnych narządów rozrodczych, natomiast robotnice pozostają bezpłodne. Za epigenetyczną promocję dzięki, której niektóre larwy uzyskują godność królowej, odpowiedzialny jest jeden silny bodziec, którym jest odpowiednia dieta w okresie rozwoju larwalnego. Epigenetyczna regulacja zmieniająca drastycznie kierunek rozwoju młodych organizmów w okresie zarodkowym jest zjawiskiem powszechnym. Występuje ona między innymi także u kręgowców, do których my również z się zaliczamy. Determinacja płci u niektórych kręgowców jest doskonałym przykładem tego jak pewne, wydawałoby się z góry ustalone, cechy mogą elastycznie poddawać się warunkom środowiska. U różnych grup kręgowców płeć może być określana przez geny lub też kontrolowana przez mechanizmy epigenetyczne. Sposób w jaki determinowana jest płeć, odróżnia np.: ssaki od sporej części gadów. U ssaków płeć jest ściśle określona przez geny, a dokładniej przez posiadanie lub brak chromosomu Y, który odpowiada za cechy męskie. Chromosom ten zawiera gen o mało obiecującej nazwie SRY, który koduje sygnał inicjujący procesy odpowiedzialne za powstanie osobnika lubiącego: samochody, piłkę nożną oraz majsterkowanie. W tym przypadku posiadanie konkretnych genów obecnych na chromosomie Y determinuje płeć męską małego ssaka. Część gadów, (np.: żółwie, krokodyle i niektóre jaszczurki) postanowiła natomiast zachować większą elastyczność w podejmowaniu tak istotnej decyzji. Płeć w ich przypadku zależy od czynnika fizycznego, a dokładniej temperatury inkubacji zarodka. Czy z jaja wyrośnie pan żółw, czy też pani żółwiowa zależy wyłącznie od temperatury otoczenia. To właśnie ciepło lub jego brak, uruchamia odpowiednie mechanizmy epigenetyczne, kierując małego gada na dalej już ściśle określoną ścieżkę rozwoju płciowego. Prosto, miło i praktycznie.

U podstaw epigenetycznej władzy nad genami leży kilka fascynujących procesów biochemicznych. Za najważniejsze z nich uznaje się: metylację DNA, modyfikację histonów oraz regulację opierającą się o niekodujący RNA. Te z pozoru niezrozumiałe terminy skrywają za sobą całkiem eleganckie, logiczne i niezbyt skomplikowane reakcje zachodzące w komórkach naszych organizmów.
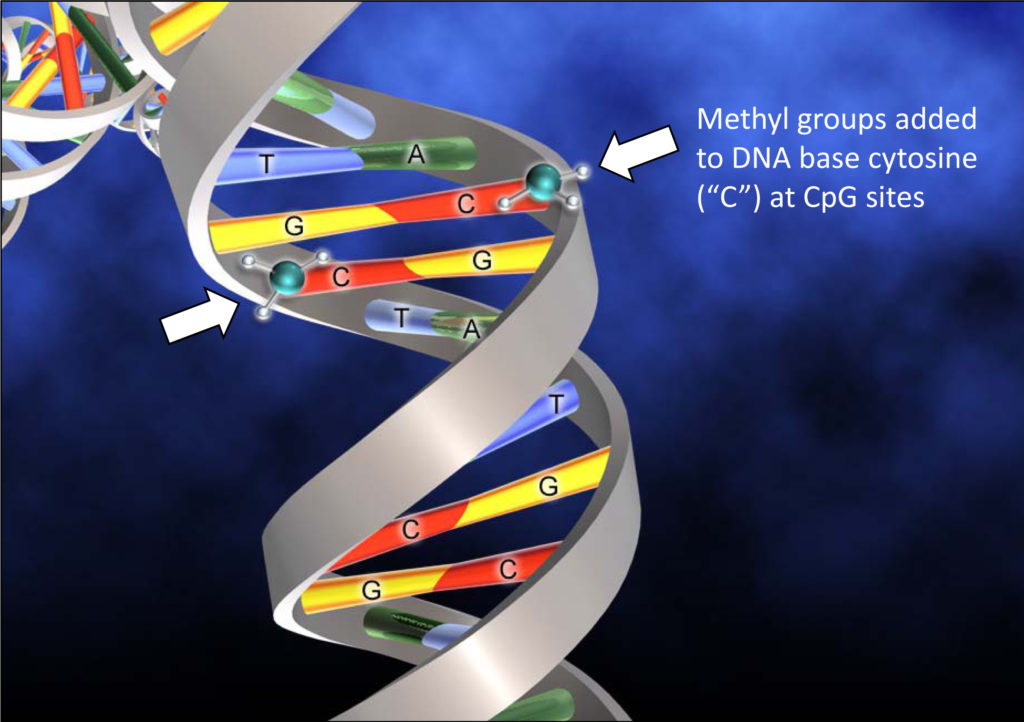
Metylacja DNA jest najlepiej poznanym sposobem kontroli epigenetycznej. Głównym bohaterem tego procesu jest grupa pracowitych enzymów nazywanych: metylotransferazami DNA (w skrócie DNMT). Metylotransferazy DNA bez wytchnienia starają się nanosić na DNA specjalne chemiczne znaczniki tzw. grupy metylowe (-CH3). Grupy te są przyłączane do jednej z cegiełek tworzących nasz genom tzw. cytozyny. DNA oznakowany z pomocą grup metylowych staje się nieaktywny, a geny znajdujące się w obszarach zawierających metylowane cytozyny przechodzą w stan uśpienia. Metylotransferazy to jednak enzymy wybredne i nie każdą cytozynę zaszczycają swoim zainteresowaniem. U kręgowców metylowane są wyłącznie te szczęśliwe cytozyny, obok, których znajduje się inna specyficzna cegiełka naszego DNA – guanina. Taki układzik cytozyny i guaniny, otwarty na nowe wrażenia związane metylacją, nazywany jest często CpG (cytozyna-fosforan-guanina). Bardzo często bezpośrednio przed samym genem występują odcinki DNA, zawierające silne zagęszczenie naszych CpG. Genetycy nazwali takie miejsca, całkiem romantycznie, “wyspami CpG”. Kiedy aktywność jakiegoś genu nie jest już potrzebna lub może być szkodliwa, cytozyny z wyspy CpG są metylowane i gen jest wyciszany. O tym jak ważne są wyspy CpG dla epigenetycznej kontroli aktywności genów świadczyć może fakt, że u kręgowców aż 70-80% wszystkich cytozyn występujących w układzie CpG jest metylowana. Każda metylotransferaza DNA, znakująca wyspy CpG, działa trochę jak „old fashion” cenzor w odległych czasach dyktatury proletariatu. Wyobraźmy sobie Edka, szefa Biura Propagandy Sukcesu, który z zapałem godnym lepszej sprawy wykreśla grubym pisakiem z artykułów prasowych, wszystkie zdania sugerujące, że jest gorzej niż wspaniale. Podobnie metylotransferaza DNA, znakując cytozyny, wycisza wybrane geny pozwalając na działanie tylko tym, które uzna za właściwe. W komórkowym świecie metylotransferaz DNA, jak w każdej złożonej organizacji, występuje podział pracy oraz specjalizacja. Cześć metylotransferaz bierze na siebie trud mozolnego przepisywania wzorów metylacji podczas kopiowania DNA, druga część zajmuje się natomiast pracą kreatywną i przyłączeniem grup metylowych w nowych miejscach. Za żmudne kopiowanie wzoru grup metylowych z nici rodzicielskiej DNA na nowoutworzoną nić podczas replikacji, odpowiada metylotransferaza DNA o prostej, lecz wpadającej w ucho nazwie: DNMT1 (więcej na temat replikacji DNA dowiecie się z wpisu pt. “Genetyczny odcisk palca”). Jest to tak zwana metylacja zachowawcza, bez której informacja, które geny mają działać, a które siedzieć cicho, byłaby tracona podczas kopiowania DNA towarzyszącego podziałom komórkowym. Oczywiście groziłoby to stałą aktywnością większości genów. Efekt byłby podobny do włączenia na wszystkich skrzyżowaniach w mieście, w godzinach szczytu, wyłącznie zielonego światła. Generalnie bez DNMT1 groziłby nam komórkowy chaos i anarchia. Jednak oprócz metylacji zachowawczej nasz DNA jest również znakowany w nowych, wcześniej nie metylowych miejscach. Jest to tzw. metylacja de novo. W ten sposób znakowania zaangażowane są dwie inne metylotransferazy DNA: DNMT3a i DNMT3b. Ich zadaniem jest działalność kreatywna polegająca na tworzeniu wzorów metylacji na przykład podczas różnicowania komórek. Bez pracy twórczej tych ważnych metylotransferaz nasze komórki byłyby nudne i jednakowe, a nas…. w ogóle by nie było.
Z metylacją związany jest również bardzo ważny mechanizm tzw. imprintingu genomowego, nazywanego również rodzicielskim piętnem genomowym. Nazwa brzmi groźnie, ale sam proces piętnowania genomowego jest nie tylko ważny i pożyteczny, ale również przyjemny. Między innymi dlatego, że związany jest z seksem. Od taty i od mamy otrzymujemy po jednej formie każdego genu (forma genu to tzw. allel). W normalnych warunkach w zapłodnionej komórce (jest to tzw. zygota) obie formy genów działają. Jednak w przypadku genów piętnowanych, tylko jedna forma genu będzie aktywna. O tym, który allel jest wyciszona, a który pozostaje aktywny decyduje, to czy przed zapłodnieniem znajdował się w komórce rozrodczej męskiej (plemniku) czy też żeńskiej (komórce jajowej). Konkretne geny są piętnowane i wyciszone przez metylację, zawsze gdy trafią do plemnika, a inne gdy trafią do komórki jajowej. Proste i niewymagające od naszych rozwojowych procesów decyzyjnych zbędnego wysiłku. Proces imprintingu przypomina trochę długą wizytą w pubie, w którym wolno palić. Nieważne czy miałeś na sobie t-shirt czy smoking, to i tak ubranie będzie “napiętnowane” charakterystycznym, smolistym zapachem. Załóżmy, że nasz gen może mieć dwie formy: A i B. Jeżeli zgodnie z ewolucyjnym porządkiem jest ustalone, że piętnowanie tego genu zachodzi w komórce jajowej, to niezależnie od tego czy trafi tam forma A czy też B, to i tak zostanie wyciszona i będzie nieaktywna. Przykładem piętnowania, w komórce jajowej jest np.: gen IGF2 (insulinopodobny czynnik wzrostu 2). W przypadku IGF2 aktywna pozostaje wyłącznie forma genu dziedziczona po ojcu. Piętnowanie rodzicielskie zachodzi podczas tworzenia komórek rozrodczych i jest ściśle ustalone. Każde ewentualne odchylenie od zasad imprintingu kończy się przykrymi konsekwencjami np.: poważną chorobą taką jak niedorozwój umysłowy towarzyszący zespołowi Angelmana. Po zapłodnieniu, już w zygocie, prawie wszystkie wcześniejsze metylacje są wymazywane i tworzone od nowa. Wyjątkiem od tej reguły są geny posiadające piętno rodzicielskie. W tym przypadku aktywność konkretnego genu zależy od instrukcji zapisanej już w plemniku lub w komórce jajowej. Warto dodać, że choć piętnowanie rodzicielskie jest procesem bardzo ważnym dla właściwego rozwoju, to u ssaków dotyczy ono mniej niż 1 % wszystkich genów. Przewidywaniem cech dziedziczonych wyłącznie po matce lub wyłącznie po ojcu było od dawna tematem, który zachęcał do spekulacji. Pułapki oraz konsekwencje dziedziczenia cech tylko po jednym z rodziców świetnie obrazuje historia interesującego spotkania sławnego pisarza George’a Bernarda Shawa z pewną piękną tancerką. Miejska legenda głosi, że George Bernard Shaw, choć był wyjątkowo błyskotliwy i inteligentny, to urodę miał raczej niezobowiązującą. Na pewnym przyjęciu miał on spotkać piękną tancerkę, która pomimo wyjątkowej urody, podobno nie wykazywała się wybitnymi umiejętnościami intelektualnymi. Podczas tego pamiętnego przyjęcia nasza piękna tancerka miała powiedzieć do Shawa: “Kochany Bernardzie, byłoby wspaniale, gdybyśmy mieli dziecko. Odziedziczyłoby ono po tobie intelekt, a po mnie urodę”. Shaw miał na tą bez wątpienia kuszącą propozycję odpowiedzieć: “A co by było, gdyby jednak odziedziczyło ono moją urodę i twój intelekt?” Trafna, choć mało taktowna odpowiedź naszego George’a Bernarda Shawa, mogłaby być pod pewnymi warunkami całkiem bliska prawdy. Szczególnie jeżeli założylibyśmy, że istnieje tylko jeden gen odpowiedzialny za urodę, oraz jeden odpowiedzialny za inteligencję. W dodatku podlegałyby one imprintingowi genomowemu. Załóżmy, że nasz pisarz posiadałby formę genu urody: brzydki jak noc, oraz genu inteligencji: mądry jak sowa. Natomiast tancerka w genie urody miałaby formę: śliczna jak z obrazka, a w przypadku genu inteligencji: głupiutka jak bucik. Jeżeli gen urody podlegałby piętnowaniu i wyciszaniu w komórkach jajowych, a gen inteligencji w plemnikach, wtedy sprawdziłby się bez żadnych wątpliwości mroczne przewidywania naszego George’a Bernarda. Oczywiście nie istnieje żaden pojedynczy gen odpowiedzialny za urodę, a inteligencję tworzy współdziałanie setek genów. Jednak przykład ten jasno pokazuje, że epigenetyka to dziedzina, która może nas jeszcze wiele nauczyć. Także w sferze życia towarzyskiego.
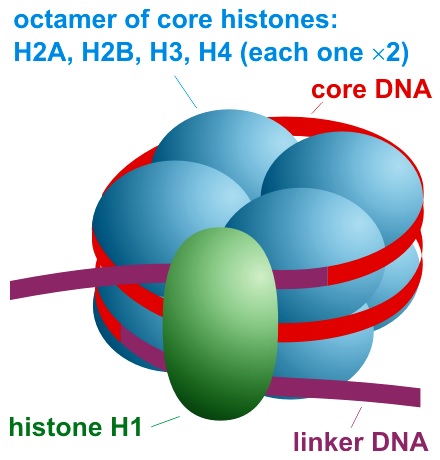
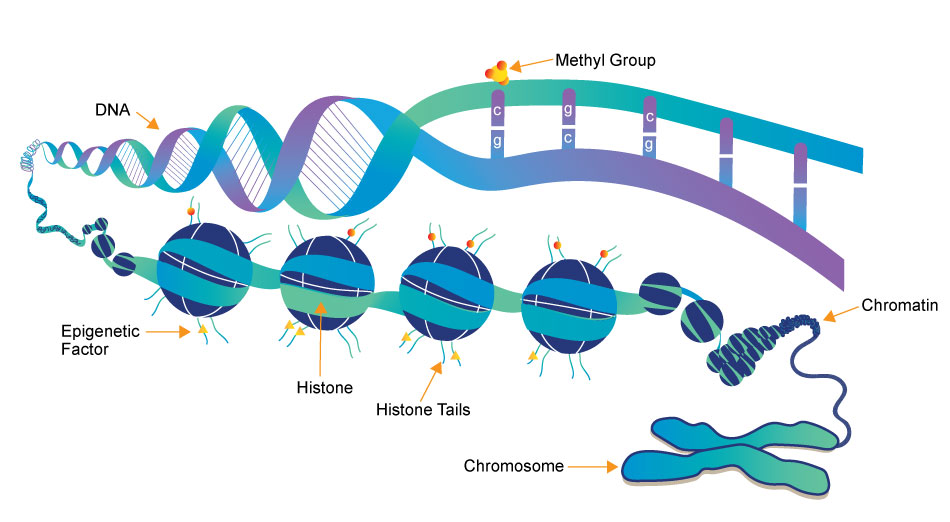
Drugim podstawowym mechanizmem epigenetycznej kontroli aktywności genów jest modyfikacja białek histonowych, nazywanych w skrócie histonami. Histony to bardzo stara i konserwatywna grupa białek. Konserwatyzm w tym przypadku nie przejawia się jednak w przywiązaniu do staromodnych garniturów z kwiatem w butonierce, czy też dziwacznych poglądach na temat głównej roli i miejsca kobiety w domu (najlepiej przykutej krótkim łańcuchem do kuchenki, zlewozmywaka oraz przewijaka). Konserwatyzm histonów nie jest, ani śmieszny ani tym bardziej szkodliwy. Oznacza on po prostu małą, ewolucyjną zmienność sekwencji DNA kodującej te ważne białka. Wynika to z kluczowej funkcji jaką pełnią histony w utrzymywaniu struktury DNA u organizmów posiadających jądro komórkowe (tzw. eukariontów). Prawie każda mutacja dotycząca histonów była zawsze szybko i bezwzględnie eliminowana przez dobór naturalny, wraz osobnikiem, który taką mutację miał pecha posiadać. Dwuniciowa helisa DNA (więcej na temat helisy możecie przeczytać we wpisie pt. “Tańczący z oligonukleotydami”) może w komórce występować w stanie rozluźnienia, kiedy to bez przeszkód udostępnia swoją informację genetyczną. Wyluzowany DNA nazywany jest zgrabnie euchromatyną. Rolą konserwatywnych histonów jest między innymi kontrolowanie aktywności DNA, przez jego ścisłe upakowanie. W formie skondensowanej informacja genetyczna zawarta na DNA jest niedostępna, a geny są wyciszone. Taki mało dostępny, skondensowany DNA nazywany jest heterochromatyną. Epigenetyczna regulacja wykorzystująca modyfikację histonów, zupełnie jak w przypadku metylacji, polega po prostu na włączania i wyłączania genów. Oto jest cały sekret epigenetyki, prosty jak obsługa lampki nocnej. Jasno, ciemno, gen aktywny, gen wyciszony. Aby jednak wyjaśnić jak działa wyciszanie genów przez modyfikację histonów trzeba przyjrzeć się jednej z najbardziej eleganckich i skutecznych konstrukcji jakie Matka Natura oraz Ojciec Ewolucja mieli okazję stworzyć. Konstrukcja, o której mowa nazywana jest nuklesomem i tworzą ją nasze konserwatywne białka histonowe wraz DNA. Dwuniciowy DNA nawijany jest na znajdujące się w regularnych odstępach kulki tworzone przez 8 białek histonowych. Każda kulka zbudowana jest zawsze z 8 histonów i nosi nazwę oktameru. Oktamer zbudowany jest z czterech histonów: H2A, H2B, H3 i H4, z których każdy występuje dwóch kopiach. W ten sposób uzyskujemy 8 histonów w każdej oktamerowej kulce. DNA nawinięty na histonowe oktamery wygląda zupełnie jak sznur korali. Cały 8 białkowy oktamer jest następnie stabilizowany przez dodatkowy histon: H1. Histon ten pełni funkcję klamerki przypominającej oktamer do genetycznego sznurka naszego DNA.
Dzięki powiązaniu nici DNA i histonów geny stają się znacznie mniej dostępne, a tym samym mniej aktywne. Stopień wyciszenia zależy jednak od tego jak ściśle DNA jest nawinięty i skondesowany. Zupełnie jak w przypadku zabawy w indian i kowboi. Jeżeli indianie zwiążą schwytanego kowboja dokładnie jak baleron, nie będzie on mógł nawet pomarzyć o ucieczce. Jeżeli jednak niezbyt przyłożą się do skrępowania jeńca lub jego więzy rozluźni np.: zakochana Pocahontas, to przy odrobinie samozaparcia blada twarz będzie w stanie oswobodzić się i uciec. Wiązanie się DNA z histonami jest spowodowane posiadaniem odwrotnego ładunku elektrycznego, który jest rezultatem ich odmiennej budowy chemicznej. Histony są naładowane dodatnio a DNA ujemnie, co sprawia, że wzajemnie się przyciągają. Można bez korzystania z przenośni stwierdzić, że jest między nimi chemia. Dzięki odpowiednim modyfikacjom chemicznym zmieniającym ładunek histonów, mogą one silniej lub słabiej wiązać się z nicią DNA. Pozwala to zgodnie z potrzebami zwiększać oraz zmniejszanie aktywności genów. Jedną z najważniejszych modyfikacji histonów jest ich acetylacja, za którą odpowiadają enzymy z grupy acetylotransferaz histonowych (HAT). Przyłączenie grup acetylowych (−C(O)CH3) do histonów usuwa ich dodatni ładunek. W rezultacie następuje osłabienie związku histonów z DNA oraz zwiększenie aktywności genów. Nasza acetylotransferaza HAT jest jednak wybredna i nie acetyluje każdego aminokwasu tworzącego białko histonowe. Acetylowana jest wyłącznie lizyna i to tylko ta która znajduje się na wystającym poza nukleosom N-końcu histonu. W odwrotny sposób działa natomiast druga grupa enzymów tzw. deacetylaz histonowych (HDAC), które mogą usuwać grupy acetylowe. Usunięcie grupy acetylowej z lizyny należącej do histonu, powoduje ściślejsze związanie się DNA z nukleosomem oraz ograniczenie aktywności genów. Proste jak mocniejsze zaciśnięcie więzów bladej twarzy stojącej przy słupie przed wigwamem. Oczywiście acetylacja nie jest jedyną możliwą modyfikacją białek histonowych. W zależności od tego jakie chemiczne znaczniki są przyłączane, możemy mieć do czynienia z: fosforylacją, metylacją, ubikwitynacją, sumoilacją. Musicie uwierzyć mi na słowo, że nie próbuję nikogo w tej chwili obrażać… Niezależnie od mniej lub bardziej egzotycznych nazw chemicznych modyfikacji, główna zasada histonowej regulacji epigenetycznej jest taka sama. Silniejsze wiązanie się DNA z histonami blokuje geny, a osłabienie tego związku zwiększa ich aktywność. Przy okazji warto dodać, że opisane wcześniej rodzicielskie piętnowanie genomowe, wykorzystuje do wyciszania genów, nie tylko o metylację DNA. W tym epigenetycznym procesie, również metylacja histonów pełni bardzo ważną rolę.
Trzeci powszechnie wykorzystywany mechanizm epigenetycznej regulacji, zależy od fascynującej grupy cząsteczek nazywanych niekodującym RNA (non-coding RNA: ncRNA). Jest to najmniej poznany i ciągle jeszcze skrywający wiele niewiadomych mechanizm epigenetycznej kontroli. Zanim przejdziemy dalej wypada krótko przedstawić nasz tajemniczy, niekodujący RNA. Zacznijmy jednak od początku. Kwas rybonukleinowy, w skrócie RNA, jest cząsteczką będącą bliskim krewnym DNA. Podstawowa i na pierwszy rzut oka widoczna różnica między tymi cząsteczkowymi kuzynami polega na tym, że skrót DNA zaczyna się od litery D, a RNA od R…. Wbrew pozorom jest to całkiem trafne spostrzeżenie. Z biochemicznego punktu widzenia RNA charakteryzuje się tym, że jego podstawowym składnikiem jest cukier prosty ryboza. W przypadku DNA analogicznym cukrem, który tworzy jego łańcuch, jest deoksyryboza. Najważniejsza różnica między DNA i RNA to po prostu wymiana D (deoksyrybozy) na R (rybozę). Zamiana ta ma jednak pewne poważne konsekwencje. DNA tworzy, śliczną dwuniciową helisę, natomiast RNA preferuje formę pojedynczej nici. DNA zajmuje się przechowywaniem i przekazywaniem przyszłym pokoleniom informacji genetycznej. RNA jest natomiast komórkowym pracownikiem sekretariatu, który przepisuje i tłumaczy ważne informacji zawarte w DNA na białka. Wydawałoby się, że RNA skazane jest na granie drugoplanowej roli, tylko po to by gwiazdor naszego genetycznego show – DNA, mógł błyszczeć jeszcze jaśniej. Ostatnie badania pokazują jednak, że RNA pełni wiele super ważnych funkcji, o których jeszcze niedawno nie mieliśmy pojęcia. Jedną z zaskakujących właściwości niekodującego RNA, jest jego wpływ na epigenetyczną kontrolę genów. Historia DNA i RNA może przypominać opowieść rodziną o dwóch siostrach, które oprócz nazwiska dzieli wszystko. Od wzrostu i urody zaczynając, na charakterze i zainteresowaniach kończąc. Ania jest liderem grupy thrash metalowej. Zmienia facetów nie rzadziej niż raz na 2 weekendy, a w przerwach między koncertami, terapią penicylinową i odwykiem, zastanawia się nad tym w jakim zaskakującym miejscu zrobić sobie kolejny tatuaż lub wstawić kolczyk. Hania natomiast z entuzjazmem godnym lepszej sprawy od 15 lat pierze, gotuje i wychowuje bachory swojego gburowatego męża. Z domu wychodzi głównie na zakupy, wywiadówki oraz by odwiedzić starą cierpiącą na demencję ciotkę. W dodatku wydaje się być całkiem zadowolona z wybranej kariery kury domowej. RNA było zazwyczaj traktowany po macoszemu jako ta brzydsza siostra lub głupszy brat DNA. Podczas lekcji biologii w szkole pomiędzy drzemką i śmiertelną nudą można było usłyszeć o trzech rodzajach RNA: mRNA, rRNA i tRNA. Najważniejszą funkcją RNA miało być przejęcie cennej informacji zawartej w DNA i zapisanie jej na mRNA w procesie tzw. transkrypcji. Następnie, należało wykuć, że informacja genetyczna skopiowana na mRNA, dzięki dalszemu wsparciu rRNA i tRNA, jest dalej tłumaczona podczas tzw. translacji na białka. mRNA nazywane jest kodującym, właśnie dlatego, że odpowiada za odczytanie informacji genetycznej z DNA i zapisanie jej – zakodowaniem, w białkach. Koniec. Wyciągamy karteczki i piszemy sprawdzian. Reset. Najnowsze badania dotyczące RNA wydają się jednak całkowicie zaprzeczać temu nudnemu wizerunkowi RNA. Obecnie poznajemy całkiem nowe funkcje tej fascynującej cząsteczki, przy których sławne DNA zaczyna wyglądać groteskowo jak aktor filmu niemego po wprowadzeniu do kina dźwięku. To zupełnie jakbyśmy dowiedzieli się, że Hania, tylko udawała zadowoloną “panią” domu. Tak naprawdę jest tajnym superagentem, zajmującym się walką z globalnymi kartelami przestępczymi. Mieszkanie cioci z demencją było jedynie przykrywką dla wejścia do tajnej bazy organizacji S.H.I.E.L.D., do której należą również: Iron Man, Kapitan Ameryka oraz Thor. RNA stało się ostatnio nowym celebrytą wśród cząsteczek badanych przez biologów molekularnych. Zmiana ta nastąpiła właśnie dzięki poznaniu setek nowych funkcji pełnionych przez nie kodującą część RNA. Jedną z odkrytych ”supermocy” naszego ncRNA jest zdolność do kontrolowania genów w procesie regulacji epigenetycznej. Niekodujące RNA pełniące funkcje epigenetyczne, w prosty sposób podzielono na: długie niekodujące RNA (long non-coding RNA: lncRNA), oraz małe niekodujące RNA (small non-coding RNA: sncRNA). Długie niekodujące RNA zbudowane są z ponad 200 nukleotydów (liter RNA), a małe zgodnie z logiką, są od tej wartości krótsze. Długie niekodujące RNA wśród wielu swoich znanych, trochę poznanych lub całkiem jeszcze nieodkrytych funkcji, zajmują się wyciszaniem genów. Przykładem jak potężny może być wpływ mechanizmów epigenetycznych na aktywność genów, jest proces wyciszania chromosomu X u ssaków. W tym konkretnym przypadku długi niekodujący RNA, nie rozmienia się na drobne i idzie na całość. Zamiast wyciszać pojedyncze geny, od razu wycisza cały chromosom. U ssaków X jest jednym z chromosomów płciowych, który wraz z chromosomem Y, decydują o tym czy młody ssak będzie w przyszłości nosił na plaży skąpe bikini czy też obcisłe kąpielówki. Noszenie bikini z dużym prawdopodobieństwem może świadczyć o posiadaniu dwóch chromosomów XX, charakteryzujących płeć żeńską. Natomiast obcisłe kąpielówki mogą potwierdzać silny wpływ posiadania zarówno chromosomu X jak i Y, czyli płeć męską. Warto jednak dodać, że na podstawie tak skąpych obserwacji żaden szanujący się naukowiec, nie powinien wyciągnąć ostatecznych wniosków bez dodatkowych badań…
Każda pani ssak otrzymuje dwa chromosomy X , jeden od mamy oraz drugi od taty. Jednak w komórkach dorosłego ssaka, zawsze tylko jeden chromosom X jest aktywny. W trakcie rozwoju zarodkowego, w sposób losowy, w części komórek inaktywowany jest chromosom X otrzymany od mamy lub ten, który dostaliśmy w spadku po tacie. Dzięki temu część komórek tworzących organizm dorosłej pani ssak, ma aktywny matczyny chromosom X, a pozostała część ojcowski. Zazwyczaj trudno jest tą różnicę zauważyć. Jednak gdy pani jest porośnięta futrem, jak to ma miejsce u kotów, aktywność matczynych i ojcowskich chromosomów X można zaobserwować gołym okiem. U kotów pomarańczowy i czarny kolor futra jest kodowany przez ten sam gen znajdujący się na chromosomie X. Gen ten posiada różne formy z których jedna odpowiada za czarne, a inna za pomarańczowe umaszczenie. Załóżmy, że tata kot był czarny a mama kocica pomarańczowa, pamiętając jednocześnie, że każda mała kocia dziewczynka nosi w połowie swoich komórek tylko jeden aktywny chromosom X, jednego z rodziców. W takie sytuacji komórki posiadające aktywny ojcowski chromosom X z genem czarnego koloru włosów, zabarwią cześć futerka na czarno. Natomiast pozostałe komórki mające aktywny chromosom X, otrzymany od mamy kocicy, zabarwią pozostałą część futra na pomarańczowo. W ten sposób hodowcy kotów otrzymują tzw. koty szylkretowe, których futro ma częściowo umaszczenie koloru czarnego oraz pomarańczowego, tworząc bardzo zgrabny paczwork. Głównym bohaterem procesu wyciszania chromosomu X jest długi niekodujący RNA nazywany Xist. Ten specyficzny lncRNA oblepia jeden z chromosomów X obecnych w komórce. Zupełnie jak graficiarz nakładający kolejną warstwę sprayu na ścianę garażu sąsiada. Xist to graficiarz sumienny, w dodatku za sąsiadem nie przepada. Dzięki temu wkrótce cały chromosom X jest dokładnie pospreyowany przez RNA naszego Xista. Obklejenie chromosomu X przez Xist pociąga za sobą z kolei liczne metylacje DNA oraz deacetylacje histonów, które powodują jak pamiętamy, dezaktywację genów. Dzięki wszystkim opisanym procesom, nasz wyciszony chromosom X nie tylko traci aktywność swoich genów, ale również zmieniania się fizycznie. Staje się bardziej zbity i kurczy się tworząc w końcu tak zwane ciałko Barra. Z inaktywacją chromosomu X związany jest ciekawy system regulacyjny. W procesie losowej inaktywacji jednego z chromosomów X bierze udział jeszcze druga cząsteczka długiego niekodującego RNA nazwana Tsix. Tsix jest pewnego rodzaju odbiciem lustrzanym Xist, gdyż sekwencje obu RNA są do siebie komplementarne (bez żadnych podtekstów i ukrytych sugestii, taki RNA nazywany jest antysensownym). Xist i Tsix to swego rodzaju genetyczne Yin i Yang. Zależność tą bardzo sprytnie uchwycono w nazwie obu cząsteczek lncRNA. Słowo Tsix to po prostu Xist odczytane od tyłu. Sekwencje RNA Xist i Tsix zupełnie jak litery swoich nazw, powstają przez odczytanie w dwie różne strony tego samego odcinka DNA chromosomu X. Gen kodujący Xist i Tsix znajduje się zarówno na chromosomie X, który zostanie inaktywowany i na tym, który pozostanie aktywny. Początkowo zarówno Xist jak i Tsix są wytwarzane na niskim poziomie przez oba chromosomy X. Jednak w pewnym momencie na chromosomie X, który zostanie inaktywowany przewagę zdobywa Xist i jego produkcja rośnie w zawrotnym tempie. Odwrotna sytuacja ma miejsce na chromosomie X, który pozostanie aktywny. Tutaj Tsix jest zwycięzcą i to jego transkrypcja rośnie lawinowo. Zakłada się, że wysoka produkcja RNA Tsix na aktywnym chromosomie X chroni go przed wyciszającymi działaniem RNA Xist.

Jednak nie tylko długie niekodujące RNA pełnią ważną rolę w procesie regulacji naszych genów. Mechanizmy wykorzystujące do kontroli genów małe niekodujące RNA (sncRNA) są równie fascynujące. Nasi kreatywni biolodzy wyróżnili kilka grup epigenetycznie aktywnych sncRNA, a następnie zgrabnie nazwali i sklasyfikowali. Biolodzy już od czasów Karola Linneusza – ojca chrzestnego współczesnej systematyki organizmów żywych, mają masochistyczne upodobanie do klasyfikowania wszystkie co klasyfikować należy, oraz tego czego klasyfikować nie warto. Przypuszczam, że wielu z nich z lubością klasyfikuje nawet własną bieliznę… gatunek: obcisłe kalesony, należący do rodzaju: spodniowate, będącego częścią rzędu: ubrań modnych w latach 70 tych…. Również małe niekodujące RNA nie uchroniły się przed tym klasyfikacyjnym skrzywieniem kochanych biologów. Dzięki temu możemy dziś z dumą wymienić trzy grupy małych niekodujących RNA, które mają wpływ na epigenetyczną kontrolę genów: siRNA (small interfering RNA), miRNA (microRNA) oraz piRNA (piwi-interacting RNA).
siRNA (small interfering RNA) – są obecnie celebrytą wśród małych niekodujących RNA. Stało się to za sprawą możliwości ich praktycznego zastosowania w opracowaniu nowych, innowacyjnych terapii oraz leków. siRNA może wyciszać wybrane geny wykorzystując interesujący mechanizm obrony, stosowany przez wiele organizmów w celu zwalczania wirusów. Dzięki spostrzegawczości biologów molekularnych odkryto, że pewien sprytny komórkowy system tnie i niszczy każdy kodujący mRNA jeżeli wcześniej w komórce pojawił się krótki fragment dwuniciowego RNA o tej samej sekwencji. Proces ten inicjowany jest przez enzym o dość sugestywnej nazwie Dicer (w wolnym tłumaczeniu szatkownica). Pełni on w komórkach funkcję imprezowego selekcjonera sprawdzającego czy gość jest na liście zaproszonych, czy też chce się wkręcić by skorzystać z darmowego bufetu i baru. Dicer dokładnie przygląda się wszystkim cząsteczkom, pływającym sobie w cytoplazmie i rozpoznaje dwuniciowy RNA (dsRNA). dsRNA jest bardzo popularnym sposobem przenoszenia informacji genetycznej przez wiele szkodliwych wirusów. Kiedy Dicer znajdzie cząsteczkę dwuniciowego RNA, tnie ją na krótsze fragmenty ok. 20-25 liter RNA (nukleotydów). Dzięki temu powstają dwuniciowe krótkie odcinki naszego siRNA, zawierające fragmenty sekwencji wirusa. Dalsze losy siRNA związane są z kompleksem kilku białek nazywanych RISC (RNA-induced silencing complex). Po przyłączeniu do RISC siRNA przekształcany jest w jednoniciowy RNA, przez degradację jednej z dwóch swoich nici. Najważniejszym elementem kompleksu RISC jest białko należące do rodziny białek o eleganckiej nazwie: Argonaute. Oprócz fajnej nazwy, białka te mają pożyteczną zdolność wiązania małych niekodująych RNA takich jak np.: siRNA. Bardzo ważną cechą RISC jest umiejętność cięcia RNA (wykazuje aktywność rybonukleazy), dzięki której pełni rolę bramkarza w komórkowym klubie nocnym. Jednoniciowy siRNA wykorzystując swoją komplementarność z sekwencją mRNA wirusa, donosi kompleksowi RISC, który mRNA jest obcy i ma wrogie zamiary. Następnie dobrze poinformowany kompleks RISC tnie delikwenta na kawałki. Na skutek likwidacji swoich mRNA wirus nie może przenieść informacji genetycznej na białka i traci szansę wystąpienia w kolejnym sezonie ewolucyjnej telenoweli. siRNA dając RISC sygnał obecności w komórce obcego mRNA działa zupełnie jak 7 letni Jasiu informujący swojego 3 lata starszego brata Heńka i jego ekipę: „Heniek! To ten w zielonych skarpetach z drugiej A, co zabrał mi piórnik i napluł do zupy”. Następnie Heniu wraz z ekipą, broniąc honoru rodziny, robi delikwentowi z d… jesień średniowiecza.

Analogiczny mechanizm stosowany jest nie tylko do walki z wirusami, ale również do wyciszania własnych genów np.: podczas rozwoju i różnicowania komórek. W tym przypadku dwuniciowe RNA nazwano jednak inaczej. RNA kontrolujący nasze własne geny włożono do osobnej klasyfikacyjnej szufladki pod tytułem: miRNA (microRNA). miRNA mają długość ok. 21-25 liter RNA, jednak w odróżnieniu od siRNA, powstają na drodze odczytania naszego własnego DNA. Krótkie sekwencje kodujące miRNA zostały w procesie ewolucji zapisane w genomie, specjalnie po to by kontrolować i wyciszać wybrane geny. Po odczytaniu w trakcie transkrypcji informacji zapisanej w DNA, powstają dłuższe odcinki prekursorowych miRNA. Zawierają one fragmenty odpowiadające sekwencji genów, które mają zostać wyciszone. Sekwencja prekursorowego miRNA jest tak skonstruowana by umożliwić przekształcenie pojedynczej nici RNA w dwuniciową formę. Dzieje się to dzięki tworzeniu tzw. struktury spinki do włosów. Kiedy jednoniciowy RNA posiada w swojej sekwencji dwa komplementarne (antysensowne) fragmenty, składa się i skleja w jedną dwuniciową strukturę. Zupełnie jak jeden kawałek taśmy klejącej, kiedy złożymy ją klejącą stroną do środka. Następnie prekursorowy miRNA podlega dalszej obróbce, której kolejnym etapem jest pocięcie na krótkie, dwuniciowe fragmenty RNA przez znany już nam enzym Dicer. W ten sposób powstaje miRNA gotowy do wyciszania genów. U roślin sekwencje miRNA są często w pełni komplementarne z sekwencją mRNA wyciszanego genu. W tej sytuacji miRNA łączy się z kompleksem enzymatycznym RISC i dalszy mechanizm wyciszania genów przez miRNA, jest taki sam jak ten, który wykorzystuje nasz dobry znajomy siRNA. Następuje pocięcie mRNA na kawałki. Jedyna różnica polega na tym, że siRNA blokuje aktywność wirusów, a miRNA wycisza nasze własne geny w ramach ich epigenetycznej kontroli. U innych organizmów np.: zwierząt, miRNA nie wykazuje jednak pełnej komplementarności z sekwencją docelowego mRNA. W tym przypadku geny są wyciszane nie dzięki pocięciu mRNA, ale przez przez jego zablokowanie. RISC zamiast ciąć mRNA łączy z jego odcinkiem, tzw. fragmentem UTR, uniemożliwiając rozpoczęcie syntezy białka (translacji). Brak pełnej komplementarności z sekwencją docelową genów daje miRNA pewną swobodę i uniwersalność, dzięki której jeden rodzaj miRNA może wyciszać jednocześnie wiele genów.
Zjawisko wyciszania genów przez dwuniciowe RNA takie jak np.: siRNA i miRNA, określane jest wspólnym terminem – interferencja RNA (RNAi – RNA interference). Proces ten został poznany całkiem niedawno, a jego odkrycie uhonorowano w 2006 r. Nagrodą Nobla z dziedziny medycyny i fizjologii. Przykład poznania mechanizmu RNAi pokazuje jak wiele odkryć może wciąż czekać na przyszłych noblistów badających procesy regulacji genów. Jeszcze kilka lat temu nie byliśmy zupełnie świadomi roli jaką miRNA pełnią w epigenetycznej kontroli. Obecnie wiemy już, że jest to jeden z ważniejszych mechanizmów wpływających na aktywności naszych genów. Zakłada się, że około 30% ludzkich genów podlega kontroli miRNA. Sprytne firmy biotechnologiczne od razu wyczuły potencjał biznesowy, wynikający z możliwości wykorzystania mechanizmu interferencji RNA. Podanie pacjentom sztucznie wytwarzanych krótkich, dwuniciowych RNA, będzie wkrótce pozwalało leczyć wiele chorób mających podłoże genetyczne. W 2018 r amerykańska Food and Drug Administration (Agencja Żywności i Leków) zaakceptowała leczenie z wykorzystaniem pierwszej terapii opartej o wyciszenie genów za pomocą krótkich dwuniciowych RNA. Nowy lek o nazwie Onpattro, opracowany przez firmę biotechnologiczną Alnylam, służy do leczenia rzadkiej choroby dziedzicznej amyloidozy hATTR. Następne rejestracje leków opartych o wykorzystanie mechanizmu interferencji RNA, będą bez wątpienia wkrótce gwałtownie podnosić poziom adrenaliny wielu brokerom handlującym akcjami firm biotechnologicznych na Wall Street.
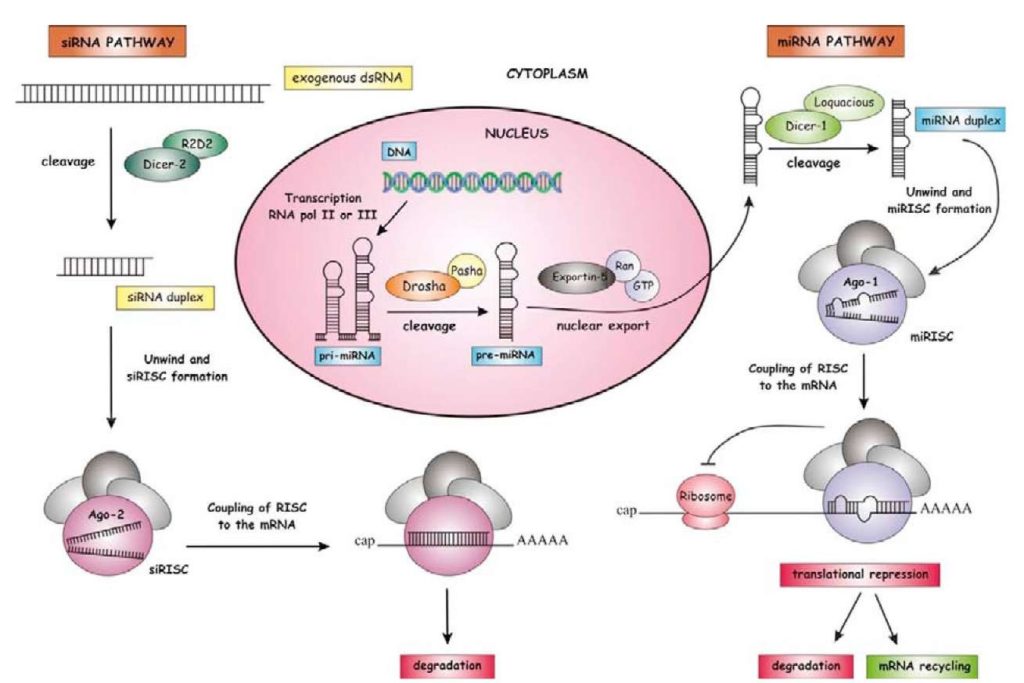
Kolejną grupą dwuniciowych RNA wykorzystywanych do wyciszania genów są piRNA (piwi-interacting RNA). Jest to wciąż jeszcze dość tajemnicza, grupa dwuniciowych RNA, której aktywność odkryto głównie w męskich komórkach płciowych. piRNA mają długość 26-31 nukleotydów i zgodnie z tym co do tej chwili zdążyliśmy się dowiedzieć, pełnią bardzo ważną rolę w wyciszaniem tzw. retrotranspozonów. Retrotranspozony, choć mają retro w swojej nazwie, są całkiem innowacyjną w swej złośliwości, częścią pasożytniczej informacji genetycznej, która w trakcie ewolucji zajęła sporą część naszego DNA. Retrotranspozony siedzą przyczajone w różnych częściach genomu. Korzystając z naszych własnych enzymów tworzą RNA zawierające ich własną, pasożytniczą informację genetyczną. Najważniejszą umiejętnością retrotranspozonów jest ich zdolność do przepisywania swojego RNA z powrotem na DNA. Tak utworzona kopia retrotranspozonu jest następnie wbudowywana się w kolejnym miejscu naszego genomu. W ten sposób pasożytniczy retrotranspozon “przenosi się” zwielokratniając jednocześnie liczbę swoich kopii. Retrotranspozony, dzięki swej umiejętności przeskakiwania w różne miejsca naszego DNA mogą uszkadzać pożyteczne geny lub zmieniać ich aktywność. Z tego powodu zdolność do utrzymywania ich „pod butem” i wyciszania, jest dla każdego z organizmu kwestią życia i śmierci. Brak umiejętności blokowania retrotraspozonów podczas tworzenia komórek płciowych jest bardzo często przyczyną bezpłodności. Z tego powodu każdy organizm posiadający skuteczny system kontroli tych pasożytniczych sekwencji, otrzymuje ewolucyjną nagrodę w postaci prawa do przekazania swoich genów przyszłym pokoleniom. Piwi-interacting RNA (piRNA) to grupa dzielnych, dwuniciowych RNA broniących nas przed aktywnością paskudnych retrotranspozonów. Nazwa piRNA pochodzi od białek PIWI, należących do znanej już nam rodziny białek Argonaute. Nie jest więc zaskoczeniem, że piRNA, łączą się z białkami PIWI. Dzięki komplementarności z sekwencją transpozonów, piRNA umożliwiają kompleksowi białek PIWI rozpoznanie pasożytniczego RNA. Jednym z poznanych sposobów wyciszania aktywności retrotranspozonów jest związanie ich RNA przez kompleks PIWI. Następuje wtedy zablokowanie możliwości przepisywanie RNA retrotranspozonu na DNA i “przeskoku” w nowe miejsce genomu. Białka PIWI z przyłączonym piRNA działają zupełnie jak teściowa wysłana wraz mężem swojej ukochanej córuni na firmowe spotkanie integracyjne. Teściowa już zadba o to by do żadnych „skoków” nie doszło…
Może wydawać się, że o epigenetycznej kontroli genów sporo już wiemy. Jednak jest to wyłącznie złudzenie wynikające ze złożoności i różnorodności mechanizmów, których nawet krótki opis zajmuje sporo miejsca. Ostatnie badania wskazują na to, że opisane sposoby wyciszania genów to nie jedyna umiejętność małych niekodujących RNA. Mogą one również pomagać w rozpoznawaniu niektórych sekwencji DNA, które są następnie metylowane. Wiemy również, że potrafią one zmieniać aktywność genów, wpływając na modyfikacje histonów. Prawda jest taka, że do pełnego poznania nawet bardzo podstawowych mechanizmów kontroli epigenetycznej jeszcze daleka droga. Bez wątpienia sporo odkryć, patentów, a być może nawet Nagród Nobla będziemy zawdzięczać dalszym badaniom epigenetycznej regulacji genów.

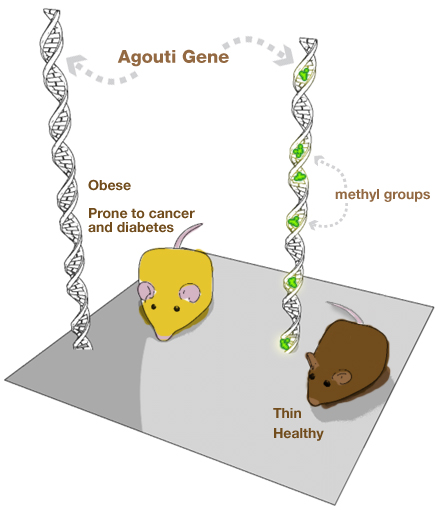
Bardzo ważną cechą naszego epigenomu jest jego elastyczność, zmienność i podatność na warunki otoczenia. Z drugiej strony epigenetyczne wyciszanie genów okazuje się często wyjątkowo trwałe. Jeszcze do niedawna, za cichą zgodą większości autorytetów naukowych, uznawano posiadanie konkretnych form genów za najważniejszy czynnik determinujący pojawienie się lub brak określonych cech i funkcji biologicznych. Ten dość naiwny, jak się okazało, sposób myślenia, był nawet myślą przewodnią rozpoczęcia prac nad pierwszym odczytaniem sekwencji genomu ludzkiego (więcej na ten temat znajdziecie we wpisie pt. “Jak zdobywano ludzki genom”). Poznanie sekwencji DNA naszego genomu, miało pozwolić na pełne zrozumienie, kontrolowanie i poprawiania ludzkiego organizmu, dzięki zastosowaniu diagnostyki genetycznej, opracowaniu nowych leków, czy też użyciu terapii genowej. Rzeczywistość okazała się jednak bardziej złożona, a co najważniejsze znacznie bardziej ciekawa. Dziś wiemy już, że nasze DNA stanowi jedynie pewną formę hardware’u informacji biologicznej. O tym które geny są aktywne decyduje złożony system regulacyjny będący odpowiednikiem biologicznego software’u. Wiele podstawowych zapisów tego epigenetycznego oprogramowania jest tworzona już na wczesnym etapie rozwoju np.: w okresie zarodkowym lub płodowym. Zapis epigenetyczny z tego okresu pozostaje często niezmienny, aż do końca życia. Dorosła pszczoła robotnica nigdy nie stanie się królową, niezależnie od tego jak wiele zjadłaby mleczka pszczelego w późniejszym okresie swojego życia. Przykro mi rozwiać złudzenia niektórych pszczół robotnic, ale ta droga awansu społecznego jest już dla was zamknięta. Doskonałym przykładem jak silny może być wpływ środowiska na organizmy w okresie płodowym jest epigenetyczna regulacja tzw. genu agouti. Agouti jest genem odpowiedzialnym za produkcję białka o intrygującej nazwie ASIP (Agouti Signal Protein). Samo białko przy bliższym poznaniu traci trochę na tajemniczości, co nie zmienia faktu, że jest ważne i pożyteczne. Decyduje ono między innymi o rodzaju wytwarzanej melaniny, będącej barwnikiem odpowiadającym za kolor skóry i włosów. Badania na myszach, które zawsze ofiarnie poświęcają się dla dobra nauki, wykazały, że dieta myszy będących w ciąży ma olbrzymi wpływ na zdrowie ich potomstwa. Kiedy ciężarne myszy były karmione pożywieniem bogatym w grupy metylowe, ich potomstwo było: szczupłe, zdrowe, a ich sierść miała kolor brązowy. W przypadku stosowania diety ubogiej w źródła grup metylowych myszy rodziły się: otyłe, ze skłonnością do cukrzycy oraz raka, w dodatku ich sierść miała kolor żółty. Okazało się, że różnice stanu zdrowia i koloru sierści naszych myszek, związane są z epigenetycznym znakowaniem genu agouti, a dokładnej poziomu metylacji jego DNA. U żółtych myszy z otyłością gen agouti był słabo zmetylowany, natomiast u zdrowych, brązowych myszek metylacje były na normalnym poziomie. Przykład genu agouti pokazuje jak istotny wpływ może mieć dieta oraz tryb życia przyszłej mamy na zdrowie dziecka. Profil epigenetyczny kształtowany podczas ciąży pozostaje z nami w dużym stopniu przez resztę życia. Każda przyszła mamy powinna pamiętać, o tym decydując się na zbilansowaną dietę oraz zdrowy tryb życia w trakcie ciąży. Przykładem składników pokarmowych niezbędnych do tworzenia prawidłowego zapisu epigenetycznego są substancje konieczne podczas procesu metylacji DNA. Są to między innymi witaminy grupy B, a w szczególności: kwas foliowy (B9), B2, B6 oraz B12.
Badania na ludziach są oczywiście zakazane, jednak czasem sami tworzymy warunki, w porównaniu, z którymi bledną sny najbardziej chorych pseudo-naukowców. W latach 1944-45 podczas ostrej zimy naziści wywołali w Holandii głód w ramach represji za wsparcie udzielane aliantom. Niedożywienie matek w okresie ciąży okazało sie mieć długotrwały wpływ na stan zdrowia dzieci, także po uzyskaniu przez nie dorosłości. Osoby, których matki w trakcie ciąży cierpiały głód, były w dorosłym życiu bardziej narażone na: otyłość, cukrzycę, schizofrenię oraz inne chroniczne problemy ze zdrowiem. Brak pożywienia podczas ciąży pozostawił również trwały ślad w epigenomie. U osób, których matki cierpiały niedożywienie w trakcie ciąży, stwierdzono między innymi niższy poziom metylacji genu IGF2 (insulinopodobny czynnik wzrostu 2).
Interesującym, ale równie trochę kontrowersyjnym, tematem jest zdolność przekazywania następnym pokoleniom cech nabytych, które zostały utrwalone w epigenomie. Proces ten nazywany jest pamięcią epigenetyczną lub dziedziczeniem epigenetycznym. Temat wywołuje sporo emocji i jest dość wrażliwy na sensację. Wynika to stąd, że pamięć epigenetyczna zaprzecza paradygmatowi, zgodnie z którym dziedziczone mogą być wyłącznie cechy zapisanych w sekwencji DNA. Opublikowano dotąd całkiem sporo przekonujących wyników badań laboratoryjnych dotyczące przekazywania cech wywołanych wpływem środowiska następnym pokoleniom nicieni o eleganckiej nazwie Caenorhabditis elegans. Nie wiemy jednak jak często proces ten zachodzi w warunkach naturalnych, jak dokładnie wygląda jego biochemiczny mechanizm, czy nie jest jednak związany z pewnymi zmianami w sekwencji DNA i co najważniejsze czy podobne zjawisko występuje u ludzi. Jest to ciągle terra incognita epigenetyki i sporo wody musi jeszcze przepłynąć w laboratoryjnych zmywarkach zanim będziemy mogli odpowiedzieć na wszystkie wymienione pytania. Niestety z obwinianiem naszej kiepskiej sytuacji finansowej, epigenetycznym piętnem hulaszczego trybu życia pradziadka hazardzisty, trzeba jeszcze poczekać.

Jednym z najciekawszych i najbardziej medialnych tematów dotyczących epigenetyki jest możliwość kształtowania i dokonywania zmian w profilu epigenetycznym. Nasz zapis epigenetyczny powstaje nie tylko podczas różnicowania komórek oraz narządów w okresie zarodkowym i płodowym. To w jakich warunkach żyjemy, to gdzie mieszkamy, co jemy, czym oddychamy oraz czym się zajmujemy, może mieć również silny wpływa na nasz epigenetyczny makeup. Lista czynników, które potencjalnie kształtują epigenom jest długa obejmuje prawie wszystko z czym stykamy się i co robimy. Na naszą epigenetyczną instrukcję kontroli genów mogą wpływać na przykład: nawyki żywieniowe i dieta, aktywność fizyczna, stres i napięcie psychiczne, rodzaj pracy (np.: praca zmianowa), używki (np.: palenie, picie alkoholu itp.), czynniki środowiska w którym żyjemy (np.: jakość powietrza i wody) itd. Wpływ środowiska utrwalony w epigenomie, najłatwiej zaobserwować u bliźniąt jednojajowych. Dzięki posiadaniu identycznego DNA, bliźnięta jednojajowe są właściwie naturalnymi klonami. Wystarczy jednak przyjrzeć się dowolnej parze starszych bliźniąt by dostrzec widoczne na pierwszy rzut oka różnice. Czasami jest to inna waga lub ilość zmarszczek. Różnice mogą jednak dotyczyć, także mniej widocznych, ale bardzo ważnych cech, takich jak skłonność do zapadania na niektóre choroby. Bliźnięta jednojajowe mogą wykazywać się innym ryzykiem zachorowania na np.: niektóre formy raka, schizofrenię czy też reumatoidalne zapalenie stawów. Różnice te wynikają między innymi z wpływu środowiska, które w trakcie całego życia odbija swoje piętno na epigenomie. Wraz z wiekiem podobieństwo między epigenetycznymi profilami bliźniąt jednojajowych maleje. Okazuje się, że liczba różnic w profilu epigenetycznym jest wielokrotnie wyższa u bliźniąt w wieku 50 lat, w porównaniu z 3 latkami zaczynającymi dopiero swoją przygodę ze środowiskiem. Wyobraźmy sobie dwa identyczne samochody, które wysłano w podróż dookoła świata, w dwóch różnych kierunkach. Kiedy nasze auta po tysiącach mil i setkach przygód, spotkają się ponownie będą już wyglądały zupełnie inaczej. Różnice wynikające z jakości dróg, parkingów, paliwa czy też zwykłej głupoty kierowców będą widoczne już na pierwszy rzut oka. Karoseria obita w różnych miejscach, podarta lub poplamiona tapicerka, a nawet sraczkowaty szlaczek namalowany przez sam środek maski. Przykład bliźniąt jednojajowych pokazuje, że nawet identyczne geny, niekoniecznie determinują posiadanie takich samych cech np.: ryzyka zapadania na niektóre choroby. Oczywiście sekwencja DNA stanowi podstawę – hardware naszej informacji genetycznej. Jednak to czy dany gen jest aktywny czy też wyłączony podlega kontroli epigenetycznego softwaru, który w pewnym zakresie może być modyfikowany. Informacja genetyczna zapisana w DNA nie jest więc aż tak wszechmogąca i determinująca jak wydawało się jeszcze całkiem niedawno. Obecnie wiemy już, że możemy próbować świadomie kształtować aktywność genów dzięki mechanizmom epigenetycznym. Na nasz profil epigenetyczny mogą wpływać takie proste decyzje dotyczące trybu życia jak: uprawianie sportu, rodzaj diety, używki lub ich brak czy też nawet ograniczenie stresu poprzez ćwiczenia relaksacyjne. Może więc czas na kolejne, postanowienie noworoczne, tym razem epigenetyczne: “W tym roku poprawię liczbę pozytywnych metylacji i acetylacji w moim epigenomie”…

Wbrew licznym popularnym artykułom oraz sprzedawanym magicznym suplementom mającym od ręki przeprogramować epigenom, wiedza jak robić to skutecznie jest jeszcze bardzo ograniczona. Przykładem pierwszych sukcesów wykorzystania naszej jeszcze niepełnej wiedzy dotyczącej możliwości wpływania na zapis epigenetyczny, jest leczenie niektórych chorób np.: nowotworów. Dzięki badaniom wiemy, że w komórkach rakowych istotnie spada poziom metylacji DNA. Powoduje to aktywację licznych genów i ułatwia namnażanie się komórek nowotworowych. U ludzi przykładem tego zjawiska jest spowodowana demetylacją aktywacja genów MYC, która jest często sygnałem przejścia do bardziej agresywnego stadium choroby nowotworowej. Ma to miejsce np.: w przypadku chłoniaki rozlanego z dużych komórek B (DLBCL). Jednak rozwój nowotworu nie zawsze związany jest aktywacją genów. Niektóre geny są przez niego celowo wyciszane. Geny, które nowotwór stara się wyłączyć najczęściej odpowiadają za systemy obronne organizmu zwalczające raka. Podstępny przeciwnik wykorzystuje modyfikacje epigenetyczne np.: hipermetylację wybranych odcinków DNA, by osłabić nasze mechanizmy antynowotworowe i móc namnażać się bez żadnych ograniczeń. Zasada tej taktyki jest taka sama jak podczas każdych agresywnych działań wojennych. Najpierw wróg niszczy system obrony by później móc bez przeszkód dokonać inwazji. Dzięki poznaniu sposobu działania raka udało się opracować, leki ograniczające metylacje. Zastosowanie blokerów metylotransferaz DNA (np.: azacytydyny lub decytabiny), pozwala na reaktywacji naszych mechanizmów antynowotworowych i kontratak. Przykład leczenia raka pokazuje jaki potencjał dla naszego zdrowia może mieć możliwość wpływania na kształt epigenomu. Jednak do pełnego poznania sekretów epigenetycznej kontroli genów jeszcze daleka droga. Oczywiście naukowcy nie próżnują i starają się uzyskać jak najwięcej informacji mogących w przyszłości pomóc zdobyć święty Graal epigenetycznego programowania genów. Badania mające na celu pełne poznanie naszego epigenomu są obecnie koordynowane przez międzynarodowe konsorcjum IHEC (International Human Epigenome Consortium). Cześć z tych badań jest prowadzona w ramach wielkiego projektu naukowego ENCODE (Encyclopedia of DNA Elements), mającego na celu ustalenie funkcji DNA genomu ludzkiego. Jest to pewna kontynuacja Projektu Poznania Genomu Ludzkiego, dzięki, któremu ustalono sekwencję naszego DNA. Dość szybko i boleśnie przekonano się, że sama sekwencja DNA bez zrozumienia co zapisuje, jest jedynie bardzo długim ciągiem liter. Projekt ENCODE ma za zadanie zapełnienie tej luki w naszej wiedzy i zrozumienie informacji zawartej ludzkim DNA. Aby to osiągnąć postanowiono poznać i opisać jakie funkcje pełnią wszystkie fragmenty ludzkiego genomu, od najmniejszych do największego. Zadanie wielkie i ważne. Jak to już wcześniej miało miejsce w przypadku Projektu Poznania Genomu Ludzkiego, wielkie projekty pochłaniają jeszcze większe, publiczne pieniądze, bez większej kontroli i co gorsza z całkiem mizernym rezultatem. Jak dotąd ENCODE idealnie wpisuje się w schemat wielkiego, drogiego i niezbyt dobrze zarządzanego projektu. Z tego powodu na efekty będziemy chyba znowu musieli poczekać, aż do wyścigu zgłosi się sektor prywatny. Tak jak nauczyła nas lekcja wyniesiona z sekwencjonowania genomu ludzkiego, nic tak nie ożywia naukowców na ciepłych rządowych posadach jak zdrowa, rynkowa konkurencja (historię wyścigu do poznania pełnej sekwencji naszego DNA, znajdziecie we wpisie pt. “Jak zdobywano ludzki genom”).
Do tego czasu jesteśmy skazani na reklamy firm oferujących supermoce po zażyciu suplementów, mających w cudowny sposób właściwie zaprogramować nasz epigenom. “Jedyna w swoim rodzaju epigenetyczna terapia. Dzięki 60 tabletkom magicznego pyłu za małe 250 zł, staniesz się piękny, młody i bogaty”. Kto chce niech wierzy. Trzeba dodać, że niektóre reklamy epigenetycznych suplementów nie tylko obiecują zdrowie i urodę nam, ale również naszym dzieciom, a być może wkrótce również wnukom. Załóżmy jednak hipotetycznie, że niektóre składniki suplementów dostępnych na rynku np.: polifenole, mają potencjalny wpływ na aktywność niektórych enzymów związanych ze znakowaniem epigenetycznym. Niestety przy obecnym stanie wiedzy nie mamy pojęcia aktywność których, genów będziemy zmieniać. To tak jakby pijany pianista na oślep uderzał w klawisze fortepianu zakładając z całą pewnością, że musi z tego wyjść Etiuda Rewolucyjna Fryderyka Chopina. Nie wiemy czy powinniśmy nadusić na gaz, czy na hamulec. Nie wiemy nawet, który pedał do czego służy. Może okazać, się że wymarzony, epigenetyczny potomek zamiast grać na wiolonczeli i uwielbiać poezję Leśmiana, będzie słuchał gangsta rapu i interesować się wyłącznie wrestlingiem.
Szylkretowe koty i myszy z nadwagą. Leczenie raka oraz pozagenowe dziedziczenie u nicieni. Wszystkie te fascynujące historie zawdzięczamy zjawiskom epigenetycznym. Chociaż jest to jeden z najbardziej podstawowych procesów, wpływających na rozwój organizmów żywych trzeba przyznać, że nasza wiedza w tym obszarze jest ciągle jeszcze bardzo niewielka. Na pewno możemy wkrótce spodziewać się wielu wspaniałych odkryć, naukowych niespodzianek i lukratywnych patentów, które stworzą kolejny fascynujący rozdział badań genetycznych. Jednak naszą epigenetyczną podróż rozpoczęliśmy od historii królowej, więc po królewsku należy ją zakończyć. Jeszcze niedawno wielu genetyków traktowało badania epigenetyczne niezbyt poważnie zakładając, że najważniejsze są geny i tylko nimi warto się zajmować. Zjawiska pozagenowe, wpływ środowiska itd. pozostawiano innym, bardziej poślednim dziedzinom biologii. Dziś jednak to epigenetyka jest jednym z najbardziej modnych i dyskutowanych tematów oficjalnych i nieoficjalnych spotkań genetyków. Bezdyskusyjnie uzyskała w ostatnich latach status królowej genetycznych salonów. Choć żadna naukowa moda nie trwa wiecznie to epigenetyka ma jeszcze tak wiele do zaoferowania, że nie wydaje się aby jej królewska pozycja miała być w najbliższym czasie zagrożona. W tej grze o tron jak dotąd Epigenetyka pozostaje niepokonana, więc… „Long live the Queen”.
Zdjęcia źródło:
- https://www.news-medical.net/life-sciences/Short-Hairpin-RNA-(shRNA)-Interference.aspx
- http://aqwwiki.wikidot.com/killer-queen-bee
- https://www.aqua.org/blog/2015/may/happy-world-turtle-day
- https://medicalxpress.com/news/2011-10-patterns-dna-methylation.html
- https://en.wikipedia.org/wiki/Nucleosome
- https://www.medgadget.com/2019/07/epigenetics-market-share-growth-trends-and-forecast-to-2025-thermo-fisher-scientific-merck-millipore-abcam.html
- https://www.drugtargetreview.com/news/32367/smchd1-protein-x-chromosome-inactivation/
- https://www.travelingwithyourcat.com/what-is-a-tortoiseshell-cat-and-how-long-does-one-live/
- https://www.hollywoodreporter.com/lists/pulp-fiction-cast-now-samuel-l-jackson-travolta-uma-thurman-1236698
- https://what-when-how.com/insect-molecular-biology-and-biochemistry/insect-micrornas-from-molecular-mechanisms-to-biological-roles-part-1/
- https://www.govtech.com/public-safety/Court-Rules-San-Diego-DA-Doesnt-Need-to-Share-Specifics-of-DNA-Analysis-Tool.html
- https://learn.genetics.utah.edu/content/epigenetics/nutritio
- https://www.dnatest.ae/
- https://www.theguardian.com/science/2015/mar/19/do-your-genes-determine-your-entire-life
- https://www.ouvry.com/en/mustard-gas-causes-epigenetic-changes-new-notions-in-the-cbrn-domain/